¿Por qué a veces no funcionan algunos fármacos contra el cáncer?
El equipo de Manel Esteller halla cómo predecir si pacientes con síndrome mielodisplásico serán sensibles a los medicamentos epigenéticos.
No solo lo que está escrito en nuestro ADN influye en nuestras posibilidades de desarrollar un tumor. Entre otros factores, también todo aquello que regula la expresión de nuestro genoma, lo que denominamos epigenética, tiene mucho que decir en el riesgo de cáncer.
Ya hay fármacos que actúan directamente sobre estas marcas químicas que pueden hacer que un determinado gen se ‘encienda’ o se ‘apague’. Estos medicamentos tienen como objetivo que las células tumorales vuelvan a parecerse al tejido normal y dejen de comportarse de forma aberrante. De hecho, cuando funcionan, consiguen cambiar la programación, el software de esas células para que dejen de ser malignas.
El problema es que estos tratamientos no siempre son efectivos, sin que se conozca todavía claramente el porqué.

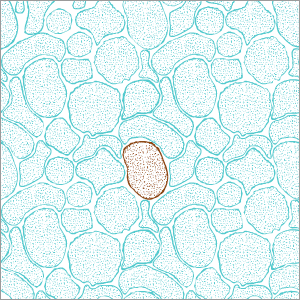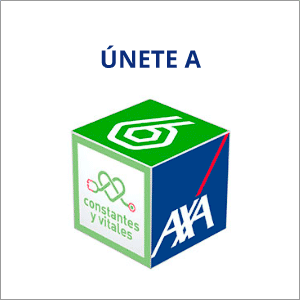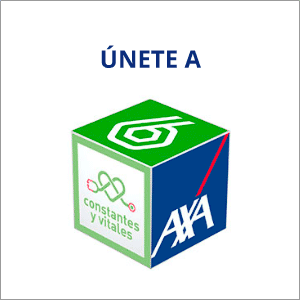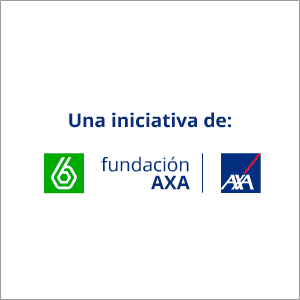
Detalle de las células tumorales tratadas con el fármaco epigenético.
Una investigación liderada por Manel Esteller, director del Instituto de Investigación contra la Leucemia Josep Carreras, profesor de investigación ICREA y catedrático de Genética de la Universidad de Barcelona, proporciona un hallazgo clave para resolver esa incógnita. Los detalles del estudio se han publicado recientemente en la revista Cancer Research Communications, la revista oficial de la Asociación Americana de Investigación del Cáncer.
Según sus datos, la persistencia de ciertas células tumorales con diferentes mutaciones se asocia con un beneficio clínico escaso de los fármacos epigenéticos.
Los investigadores se centraron en el estudio de los síndromes mielodisplásicos, un conjunto de tumores de la médula ósea, cuyo tratamiento de elección es precisamente un fármaco epigenético, la azacitidina, que actúa inhibiendo la metilación del ADN. En aproximadamente 1 de 3 pacientes, el síndrome mielodisplásico puede progresar y convertirse en una leucemia mieloide aguda.
Los científicos analizaron más de 90.000 células de 14 pacientes tanto antes como después de la terapia para identificar cualquier cambio importante en el genoma e inmunoproteoma. Cristina G. Lucio